外泌体:极具潜力的再生医学技术及药物递送工具(上)
时间:2023-10-18来源:中国医药报
□ 吴夏 吴莎莎
外泌体是一种40~160nm的细胞外囊泡,可由血细胞、免疫细胞、肿瘤细胞、干细胞等在内的几乎所有类型的细胞分泌,并分布在各种体液中。外泌体是细胞间通讯的关键介质,及各种生理和病理过程中的功能介质。
研究发现,外泌体可以穿梭蛋白质、脂质、RNA和DNA等生物活性分子,且具有高生物利用度、生物稳定性、靶向特异性、低毒性和低免疫原性,使得外泌体在疾病诊断、治疗及药物递送中极具潜力。
美国ClinicalTrials临床试验数据库资料显示,外泌体可作为肺癌、乳腺癌、结肠直肠癌等不同肿瘤的诊断生物标志物或治疗药物,还可作为药物递送系统、肿瘤疫苗;此外,外泌体还可用于再生医学。然而,至今尚未有任何的外泌体疗法批准上市,外泌体的临床转化仍面临着诸多问题及挑战。
外泌体发展历程
外泌体是细胞外囊泡常见亚群之一。EV是由生物细胞分泌的纳米级具有双层膜结构的囊泡,是各种具有膜结构的囊泡的统称,主要包括外泌体及微囊泡、微粒、外体、迁移体、肿瘤体和凋亡体等。现代研究证明,外泌体可影响肿瘤的各种生物学过程,包括细胞增殖、肿瘤转移、血管生成、肿瘤耐药和免疫反应等。
1981年,Trams等人从各种正常细胞和肿瘤细胞中培养出具有5′-核苷酸酶活性的脱落囊泡,囊泡的平均直径为500~1000nm,并且通常含有直径约40 nm的第二群囊泡,这是关于外泌体的最初描述。1983年,Harding等人和Pan等人分别在大鼠和绵羊网织红细胞中,观察到含有未降解的转铁蛋白受体与直径约50 nm的小囊泡发生相互作用。随后在1987年Johnstone将其正式命名为“外泌体”。
2013年,James E. Rot hman、Randy W. Schekman和Thomas C. Südhof三位科学家因发现并阐释细胞囊泡运输系统及调控机制而获得诺贝尔生理学或医学奖。
外泌体的组成及生理功能
外泌体含有DNA、RNA、mRNA、脂质、代谢物、细胞质和蛋白质等多种生物分子。研究显示,目前已在外泌体中鉴定出9769种蛋白质、2838种miRNA、3408种mRNA和1116种脂质。其中,细胞膜常规的四跨膜蛋白(CD9、CD63、CD81等)、热休克蛋白70(Hsc70)、溶酶体蛋白(Lamp2b)、肿瘤敏感基因101(Tsg101)、融合蛋白(CD9、flotillin,annexin)等蛋白在外泌体中的浓度较高,可作为外泌体鉴定的生物标志物。
近年来,研究发现血细胞、免疫细胞、肿瘤细胞、干细胞等在内的几乎所有类型的细胞都可以产生外泌体,进行细胞间通讯,从而实现细胞增殖、分化、免疫调节、炎症调控、细胞凋亡等多种生物学功能。
外泌体最初被认为是细胞用来排泄废物的小泡,随着研究的深入,发现外泌体可参与到机体免疫应答、抗原递呈、细胞迁移、细胞分化、肿瘤侵袭等。
不同细胞来源的外泌体组成不同,其功能也不同。例如,树突状细胞分泌的外泌体具有MHC肽复合物,能够激活T细胞,还可表达表面配体,如肿瘤坏死因子配体(TNF)、Fas配体(FasL)和TNF相关的凋亡诱导配体(TRAIL),从而和肿瘤细胞上的TNF受体结合,触发半胱天冬酶活化和肿瘤凋亡。干细胞来源的外泌体包含与MSCs类似治疗性的生长因子及mRNA等生物活性物质,具有免疫调节、组织修复等疗效。癌细胞来源的外泌体能发挥免疫调节功能,导致免疫抑制或避免免疫反应。
外泌体的分离方法
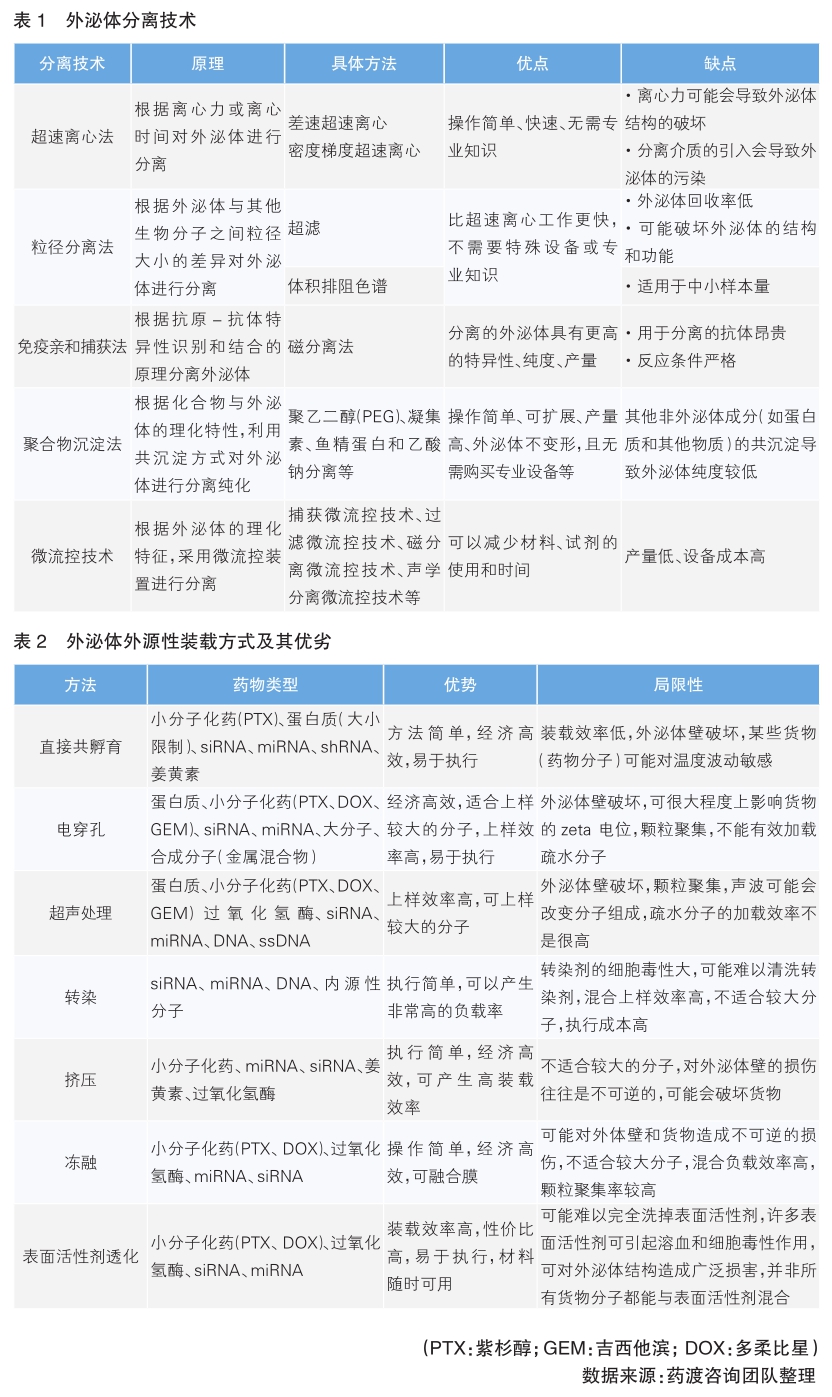
目前,研究人员已根据外泌体的大小、密度、表面电荷以及其表面相关的蛋白质开发了多种外泌体分离方法,主要包括超速离心、超滤、体积排阻色谱、免疫亲和捕获、聚合物沉淀法和微流控技术(各技术原理及优缺点见表1)。
由表1可知,外泌体分离方法已得到大量扩展,常用方法有差速超速离心、密度梯度离心法、沉淀法、过滤法、体积排阻色谱法以及免疫亲和捕获法等,其中差速超速离心仍是长期以来外泌体分离的“金标准”。然而,目前分离技术都存在一定缺陷,如何提高外泌体分离的纯度、效率和质量仍是攻克外泌体分离技术难题的主要挑战。
外泌体临床应用
外泌体几乎存在于所有的细胞、组织和体液中,是介导细胞间通讯的重要介质。研究认为,外泌体可通过与细胞膜直接融合,以及通过内吞途径或配体-受体相互作用在细胞间通讯中发挥作用,从而参与到机体免疫应答、抗原递呈、细胞迁移、细胞分化、肿瘤侵袭等。
目前,外泌体被广泛用于生物标志物、药物载体和疾病治疗研究中。
药物递送系统
外泌体可通过内吞作用或经过囊泡和细胞膜的直接融合进入受体细胞,使其内容物输送到细胞质中并引发功能反应。如来自抗原呈递细胞(树突状细胞)的外泌体可以通过将负载肽的MHCⅠ类和Ⅱ类复合物转移到T细胞,来调节免疫细胞反应。
外泌体作为一种潜在的药物递送系统,类似于脂质体,具有包裹亲水核心的独特双脂膜,可装载亲水和亲脂材料;由于外泌体具有不同脂质、表面蛋白、受体等,具有更好的组织和细胞靶向性;此外,外泌体由细胞自身产生,具有较好的生物相容性、低免疫原性和低毒性,可避免外源性的蛋白类、核酸类等药物进入体内被免疫系统识别而遭到清除。目前,应用外泌体载药的药物类型主要为小分子化药、核酸和蛋白质。
外泌体载药方式可以分为外源性装载(即外泌体分离后)和内源性装载(即外泌体生物发生期间)两种。
内源性装载是在外泌体形成的生物过程中,通过直接转染、共孵育等方法将目的药物导入外泌体来源细胞,来源细胞再通过生物发生机制产生具有目的药物的外泌体。目前,内源性装载可装载RNA、蛋白质、小核酸和小分子等不同类型药物。
外源性装载是通过电穿孔或脂质体转染等方法将目的药物导入分离后的外泌体中。目前,外源性装载可装载小分子化药、蛋白质、多肽、核酸药物、天然产物等,装载药物方式主要包括直接共孵育、电穿孔、超声处理、转染、挤压、冻融、表面活性剂透化(详见表2)。
诊断及预后标志物
外泌体已被证明有望用作许多疾病的诊断和预后生物标志物,包括乳腺癌、泌尿道癌、肺癌、胃癌、肝癌、结直肠癌、卵巢癌等癌症,以及帕金森病、阿茨海默病等中枢神经系统疾病,并且关于外泌体作为诊断工具的研究正在迅速扩展到其他疾病。
目前研究结果显示,外泌体蛋白、miRNA、circRNA、l ncRNA均具有潜在的诊断和治疗价值,如外泌体蛋白CD26、CD81、S1C3A1和CD10可用作为肝损伤潜在的生物标志,外泌体miR-21和miR-1246在乳腺癌患者中升高更为显著,可作为乳腺癌的生物标志物。外泌体生物标志物与传统生物标志物(血清、尿液等)相比,具有更高的灵敏度和特异性,以及更出色的稳定性。
疾病治疗
近年来,研究证实外泌体对多种疾病具有治疗潜力。例如,研究发现,外泌体可以穿过血脑屏障,作为炎症反应和神经损伤再生的调节剂;从心球源细胞中分离的外泌体,当注射到缺血小鼠模型中时,可以抑制细胞凋亡并诱导心脏细胞的生长,等等。外泌体的治疗作用基于其细胞内穿梭能力、穿越血脑屏障能力、低免疫原性、调节免疫系统以及增加或抑制炎症的能力等。
与干细胞相比,外泌体在临床治疗的潜在优势包括:无任何基于细胞的疗法(包括干细胞)相关的固有风险;无复制潜力和恶性转化的风险;可避免对感染和癌症的免疫原性反应;可直接靶向目标组织或细胞。 (作者单位:药渡咨询)

